


AMBULATORIO DI GENETICA MEDICA
GENETICA MEDICA GENETICA PEDIATRICA
GENETICA MOLECOLARE CITOGENETICA GENETICA ONCOLOGICA IMMUNOGENETICA
AMBULATORIO DI GENETICA MEDICA
E PUNTO PRELIEVI
 UOC GENEDICA MEDICA
UOC GENEDICA MEDICA
CONVENZIONATO SSN*
ANALISI DEI CASI DI SCREENING PRENATALE GENETICO NON INVASIVO 2013-2020
In otto anni di attività a partire dalla primavera 2013 ad oggi hanno eseguito nella nostra esperienza test genetici prenatali non invasivi 4000 pazienti afferenti dalle province di Parma, Reggio Emilia, Piacenza, Mantova, Cremona in ordine decrescente. Parte delle pazienti da Reggio Emilia si sono appoggiate su altro centro.
Analisi cromosomica su DNA fetale in plasma materno. Analisi dei casi.
La tabella 1 mostra che 4000 pazienti hanno analizzato le tre trisomie T13,18,21: due casi di discordanza per T18, uno falso positivo (verifica LA, US normale) e uno falso negativo (anomalie ecografiche) confermato su LA. Il falso negativo è previsto in <1/1000, quindi il dato è nella norma. Per quanto riguarda la vitalità dei casi patologici al momento del test, presentavano morte endouterina 5/15 T21, ½ T13, ½ 45,X, 2/2 T15. La conoscenza della causa della IUD è sempre stata valutata utile dalle pazienti, malgrado l’esito infausto.
Sempre Tabella 1 mostra 1140 pazienti della coorte di 4000 che hanno eseguito il cariotipo molecolare: 1 caso di duplicazione parziale del cromosoma 12 è stato confermato su villi coriali; essendo la ecografia normale si procedette ad amniocentesi con esito normale: discordanza feto-placenta.
Tabella 1

Prevalenze.
Le T13,18,21 nella nostra coorte hanno prevalenze superiori alla media di popolazione europea, T21 ha 3,7 ‰ (popolazione 1,2‰), T18 ha 1,5‰ (popolazione 0,5‰), T13 ha 0,5‰ (popolazione 0,06‰). La nostra coorte aveva un rischio di trisomie medio alto. La prevalenza complessiva delle trisomie è di 5,7‰. Se ci soffermiamo ai casi vitali con probabile arrivo a nascita la prevalenza scende a 4,5‰.
Malattie mendeliane frequenti. Ricerca del portatore sano eterozigote.
A partire dal 2015 è stata introdotta la ricerca dei portatori sani eterozigoti per le malattie mendeliane gravi, frequenti e subdole, cioè con prevalenza >1? e non riscontrabili altrimenti in epoca prenatale.
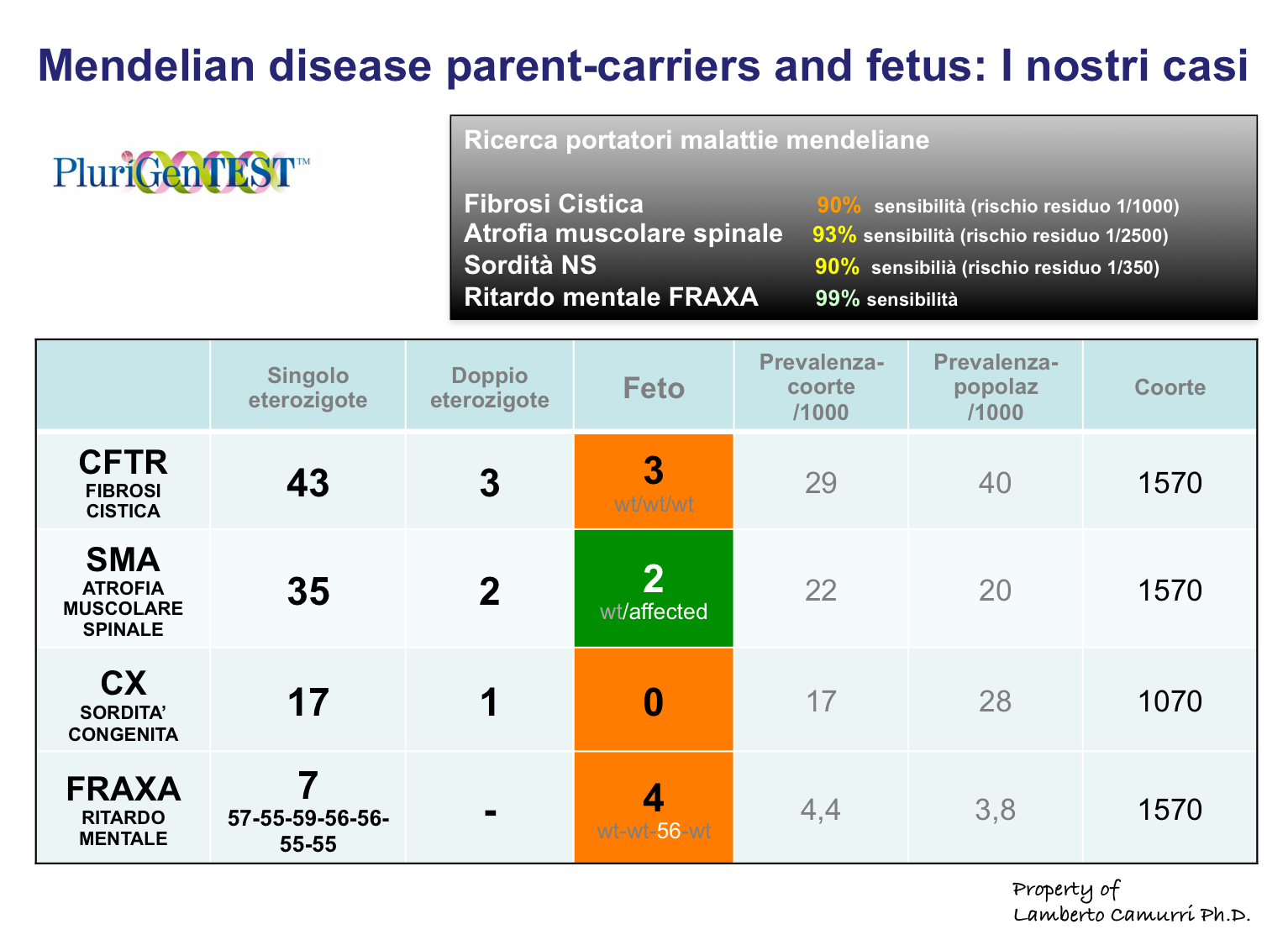
Tabella 2 mostra 1570 pazienti che hanno eseguito il test per Fibrosi Cistica, SMA, Xfragile, 1070 per la sordità neurosensoriale.
Fibrosi Cistica: 43 pazienti risultarono eterozigoti con partner negativo, 3 pazienti eterozigoti con parter eterozigote. La analisi fetale diede 3 feti normali.
Atrofia Muscolare Spinale SMA: 35 pazienti risultarono eterozigoti con partner negativo, 2 pazienti eterozigoti con parter eterozigote. La analisi fetale diede 1 feto affetto SMA, 1 feto normale.
Xfragile: 7 pazienti risultarono portatrici della espansione premutata, 4 eseguirono la analisi fetale: 1 feto fu definito premutato con allele materno conservato, 3 ereditarono il cromosoma normale della madre.
Tabella 2
Prevalenza.
Le prevalenze della coorte sono disomogenee. La Fibrosi cistica ha prevalenza dell’eterozigote nella coorte di 29‰ (popolazione 40‰), la SMA ha prevalenza nella coorte di 22‰ (popolazione 20‰), la Xfragile ha prevalenza nella coorte di 4,4‰ (popolazione 3,8‰), la Sordità Neurosensoriale ha prevalenza nella coorte di 17‰ (popolazione 28‰). La prevalenza complessiva dei portatori eterozigoti nella coorte è di 65‰, di entrambi i partner portatori eterozigoti è 5‰, feti affetti 1,3‰.
Conseguenza dei dati di prevalenza è il quadro ereditario familiare dopo la identificazione del portatore eterozigote.
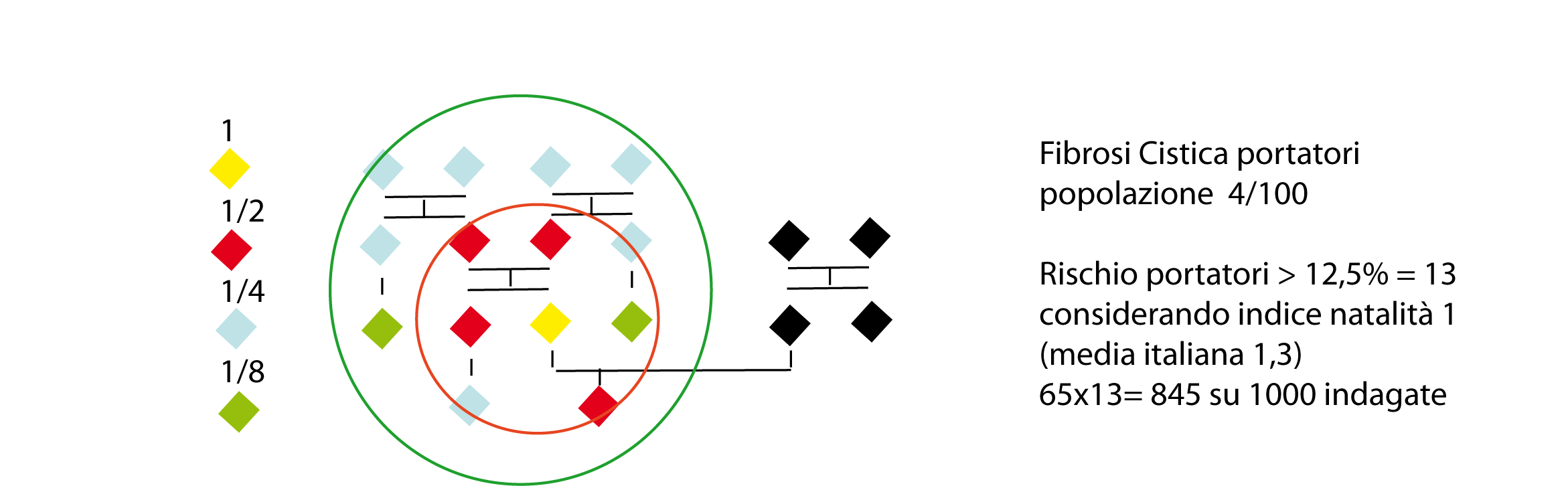
Figura 1 mostra il quadro genealogico ipotetico attorno al portatore ponendo l’indice di fertilità pari a 1. Avendo testato solo il portatore identificato in giallo, il numero di familiari potenzialmente portatori della mutazione con una probabilità superiore al 10% sono 13. Nella nostra coorte di 1570 pazienti, i 65 portatori coinvolgono a priori 845 persone nella fascia di rischio >10%.
Ne consegue che la identificazione del portatore eterozigote ha doppia importanza:
1. definizione del rischio riproduttivo per la paziente 2. promuove la estensione della analisi ai familiari a maggior rischio (fascia rossa) per definire il rischio personale 3. conseguenza finale è la bonifica delle coorti familiari riducendo il numero dei potenzialmente portatori (>10% rischio).
Figura1.
Follow up.
Il piano per il 2021 prevede il recupero delle pazienti risultate portatori eterozigoti con la verifica del follow up e la proposta di analisi sul prodotto del concepimento (caso indice, 50% probabile portatore) e familiari di area rossa.
Potenziamento dello screening sulla popolazione afferente alla struttura considerando che non solo in epoca periconcezionale vale lo screening, ma ogni persona adulta può essere utile ai propri familiari e nipoti!